实验原理
免疫荧光技术是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光素,制成荧光抗体,再用这种荧光抗体(或抗原)作为探针检测组织或细胞内的相应抗原(或抗体)。在组织或细胞内形成的抗原抗体复合物上含有标记的荧光素,利用荧光显微镜观察标本,荧光素受外来激发光的照射而发生明亮的荧光(黄绿色或橘红色),可以看见荧光所在的组织细胞,从而确定抗原或抗体的性质、定位,以及利用定量技术测定含量。
实验步骤
1. 洗载玻片:将载玻片置于重铬酸钾和浓H2SO4混合液中,目的是为了是载玻片上的硅胶等除去,同时使一些肉眼看不见的凹凸不平的表面变平整,便于组织吸附,然后置于清水中清洗,除去残余的重铬酸钾和浓H2SO4(大约冲一个小时左右),再将载玻片浸泡于酒精之中,然后放到架子上,置于37°C温箱中,将多聚赖氨酸涂布于玻片的表面,由于Lys带正电,而大多数的组织带负电荷,从而产生吸附作用。
2.包埋组织:先在铁模具中加入一些液态石蜡,先稍微冷却,然后再将待包埋的组织置于石蜡之中,并排列整齐,再将塑料模具盒盖上,最后加入少许液体石蜡,进行冷冻,使石蜡变成固态。
3.切片:将包埋好的组织从模具上取下来,并置于石蜡切片机上,切片机通过调节上下左右来来使组织和切割方向一致,然后调节切片的厚度,一般为 5μm,如果比较难切,则可以适当调整厚度,用毛笔将切割的载玻片向外拉,并用小镊子将包含有完整组织的载玻片置于40°C温水中。
4.捞组织:当组织载玻片置于40°C温水中之前,要先将水浴中的气泡赶走,以免气泡受热上浮而贴到组织上,组织受热展开,最好是组织不起皱纹,用载玻片捞组织时,一般取载玻片的下1/3或者下1/2一般每种组织捞5-6张,其中2-3张是备用的,每张载玻片上通常捞两份组织,做对照使用,这样形成的误差就比较小了,而且捞载玻片的时候最好方向一致,以便观察,再将捞出来的载玻片置于架子上,放入37°C温箱中烘干。
5.脱蜡:依次将载玻片放入二甲苯-二甲苯-100%酒精-100%酒精-95%酒精-90%酒精-80%酒精-70%酒精,起脱蜡作用的主要是二甲苯, 依据的是相似相溶的原理。一般在每个试剂中放10min,天气热可以少放几分钟,相反,天气较冷的话,就要适当延长脱蜡时间,一般为12-15min。
6.抗原修复:我们采用电陶炉进行抗原修复,将脱蜡水化后的组织切片置于烧杯(或修复盒)中的耐高温塑料切片架上,加适量的修复液(0.01M枸橼酸缓冲液,pH6.0)于烧杯中,液面要浸过切片组织一定高度,电陶炉可先用高档加热使液体沸腾,当加热至沸腾时调到中档,此时开始计时,修复时间为15min,此过程中勿使组织干片(修复液要足量)。到时间后将烧杯从电陶炉中取下,自然冷却,当修复液降至室温后取出玻片,用PBS(PH7.4)冲洗3遍,每次3min(冲洗过程中切勿对着组织冲洗,以免弄破组织)。
7.血清封闭:冷却至室温后,将柠檬酸缓冲液倒掉,水洗2次,并将载玻片置于PBS中5min,洗2次,擦干组织周围的PBS液,马上加上血清,使一些非特异性的位点封闭起来,然后放入37°C温箱中半小时。血清稀释10倍(900μlPBS:100μl血清封闭液)。
8.加一抗:将温箱中的载玻片取出,用吸水纸擦干载玻片反面和正面组织周围的血清,加一抗,如果做对照实验,就在对照的组织上加PBS。加完一抗后于4°C冰箱中保存过夜。
9. 加荧光二抗: PBST冲洗切片3次,每次3min,吸水纸擦干切片后滴加稀释好的荧光二抗,湿盒中37℃孵育1h,PBST冲洗切片4次,每次3min。(注意:此步骤及后面所有操作步骤都尽量在暗处进行。)
10. 复染核:滴加DAPI避光孵育5min,对标本进行染核,PBST 5min×4次洗去多余的DAPI。
11. 用吸水纸擦干切片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
结果判读
目的蛋白为红色或者绿色(荧光素不同颜色不同),细胞核为蓝色;
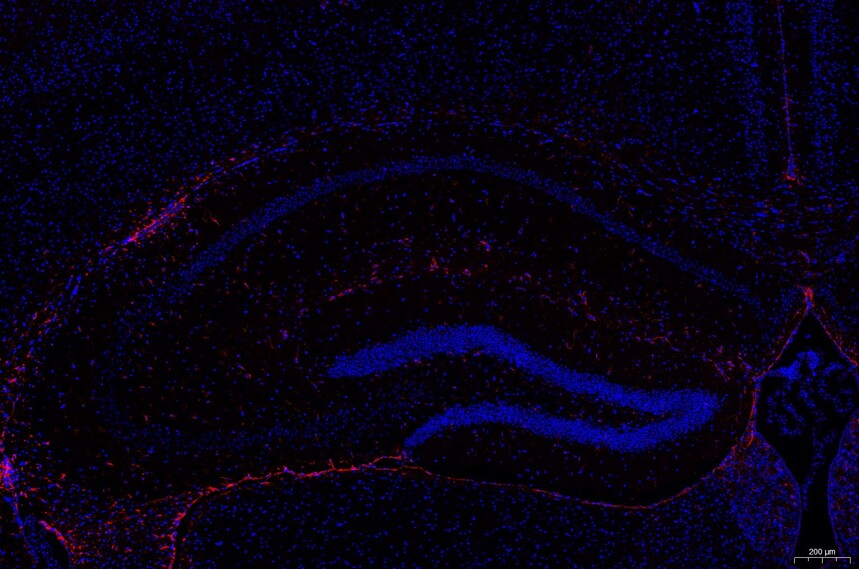
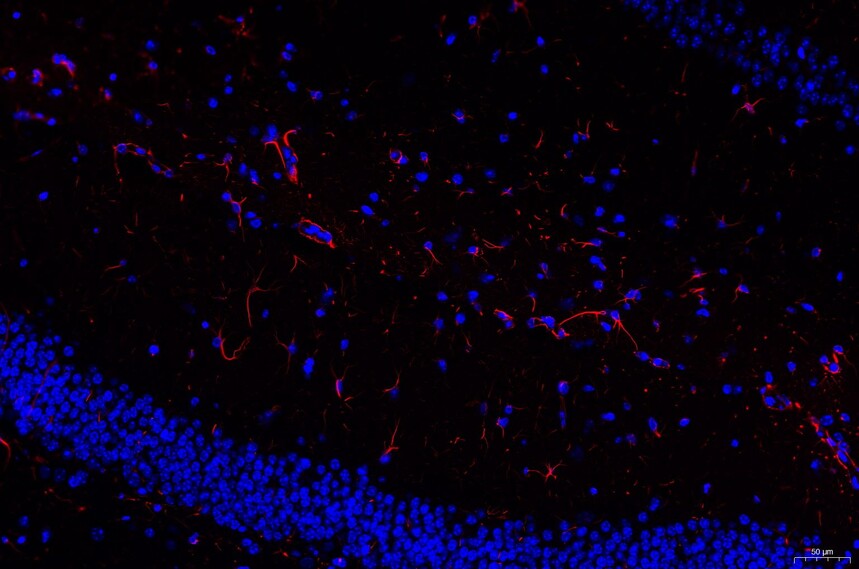
注意事项
1,目标蛋白的荧光很弱,导致组间差异并不明显,造成假阴性结果;
2,蛋白荧光太强,甚至形成非特异性的标记,一些背景染色可能被误认为阳性区域,造成假阳性结果;
3,DAPI染细胞核时,加入的试剂太多,造成高背景染色;
4,组织切片预处理不当或采用石蜡切片,导致高背景染色;
5,采集图像过程不当,导致原始图像不佳,直接影响后续半定量分析。
常见问题解析
1、非特异性染色
原因:1)检查所用荧光团的光谱是否重叠:调整滤镜和光源,更改为激发光谱或发射光谱没有重叠的荧光团。
2)一抗种属来源与被分析的样本物种相同:更换抗体;使用与二抗来源物种相同的血清作为封闭液;用针对一抗种属的单价Fab片段封闭一抗,然后用二抗对单价Fab片段进行可视化,可避免与样本本身的Fc受体结合而引起非特异染色。
3)切片中存在杂质引起非特异荧光:二抗使用前离心,将不溶杂质或游离的染料沉淀到底部,吸取上清进行实验;甲醛固定后样本,可用甘氨酸淬灭残留的醛。
2,弱染色
可能是由多种原因引起的:检查曝光时间和强度;改变固定或孵育时间;确保抗体/同型的兼容性;测试抗体稀释范围和样品浓度;保证正确的试剂和载玻片的制备和储存方法;检查设备不兼容性。
3、背景信号
原因:1)试剂或样本问题:降低抗体浓度(一级或二级);使用较薄的组织切片;通过对照检查二抗特异性,如果发生非特异性结合,则更换二抗。
2)封闭可能不足:增加封闭孵育时间或使用其他封闭剂;用与二抗种属相同物种的正常血清封闭。
3)可能是由于自发荧光引起的:检查未染色的部分;游离醛可以用硼氢化钠洗涤除去,并避免使用戊二醛固定剂;预光漂白内源性分子,导致使用苏丹黑染色;减少显色的孵育时间;考虑远离488 nm通道,并使用与自发荧光不同的发射波长的荧光团。
4、目标蛋白的荧光很弱,导致组间差异并不明显,造成假阴性结果
原因:首先要检查一下抗体对不对,是否适用于你的预处理组织。一个典型的例子就是,有些抗体只适用于冰冻切片,但若将其应用于石蜡切片,就会造成弱标记或无标记现象。此外,如果抗体修复不充分,抗原表位未完全暴露,也会出现弱标记现象。比如,尽管大多数抗体都是在酸性环境中修复,但是也存在少量的抗体需要在碱性环境中修复,建议查看抗体说明书,严格按照其修复条件进行实验。
5、目标蛋白的荧光太强,甚至形成非特异性的标记,一些背景染色可能被误认为阳性区域,造成假阳性结果
原因:一般出现在抗体浓度过高而漂洗又不充分的时候。多余的抗体会吸附在组织上,造成荧光图像整体高背景。适当降低一抗或者二抗的浓度,增加漂洗时间,一般能够有所改善。
6、DAPI染细胞核时,加入的试剂太多,造成高背景染色
现在都是使用的防荧光衰减DAPI试剂,使用时滴上一滴就能将细胞核标记。
原因:滴加的DAPI不要太多,只需覆盖上薄薄的一层即可。事实上,个人认为只要切片没有暴露在自然光或者激发光之下,荧光的自然衰减并没有想象中那么快。
7、组织切片预处理不当或采用石蜡切片,导致高背景染色
如果组织切片,尤其是石蜡切片脱蜡环节不彻底,也会造成区域性的非特异性标记。建议脱蜡一定要彻底,脱蜡前充分烤片也可以帮助脱蜡。
原因:玻片干燥了,同样会造成高背景或大面积的非特异性标记。漂洗环节和抗体孵育环节最容易出现干片现象,尤其是大批量实验时,一定要注意。使用免疫组化专用笔画个圈,可以有效改善。
送检要求
样品类型 | 样本需求 | 保存条件 | 运输条件 |
动物组织 | 单个样品大于0.1g | -80℃ | 干冰 |
种子样本 | 单个样品大于0.2g | -80℃ | 干冰 |
细胞样本 | qPCR/WB:单个样本不少于106个细胞 | -80℃ | 干冰 |
血液样本 | 骨髓1-3ml;用抗凝管保存的外周血5-10ml | -80℃ | 干冰 |
石蜡包埋样本 | 包埋石蜡块大于0.1cm | -20℃ | 冰袋 |
抗体 | 提供足量,并附带抗体说明书 | -20℃ | 冰袋 |
引物 | 如需预实验,引物两对,附带引物合成单 | -20℃ | 冰袋 |
备注:每个样本仅保留唯一且清析可识的标记;邮寄前请与公司专业人员确认方法最佳; | |||

