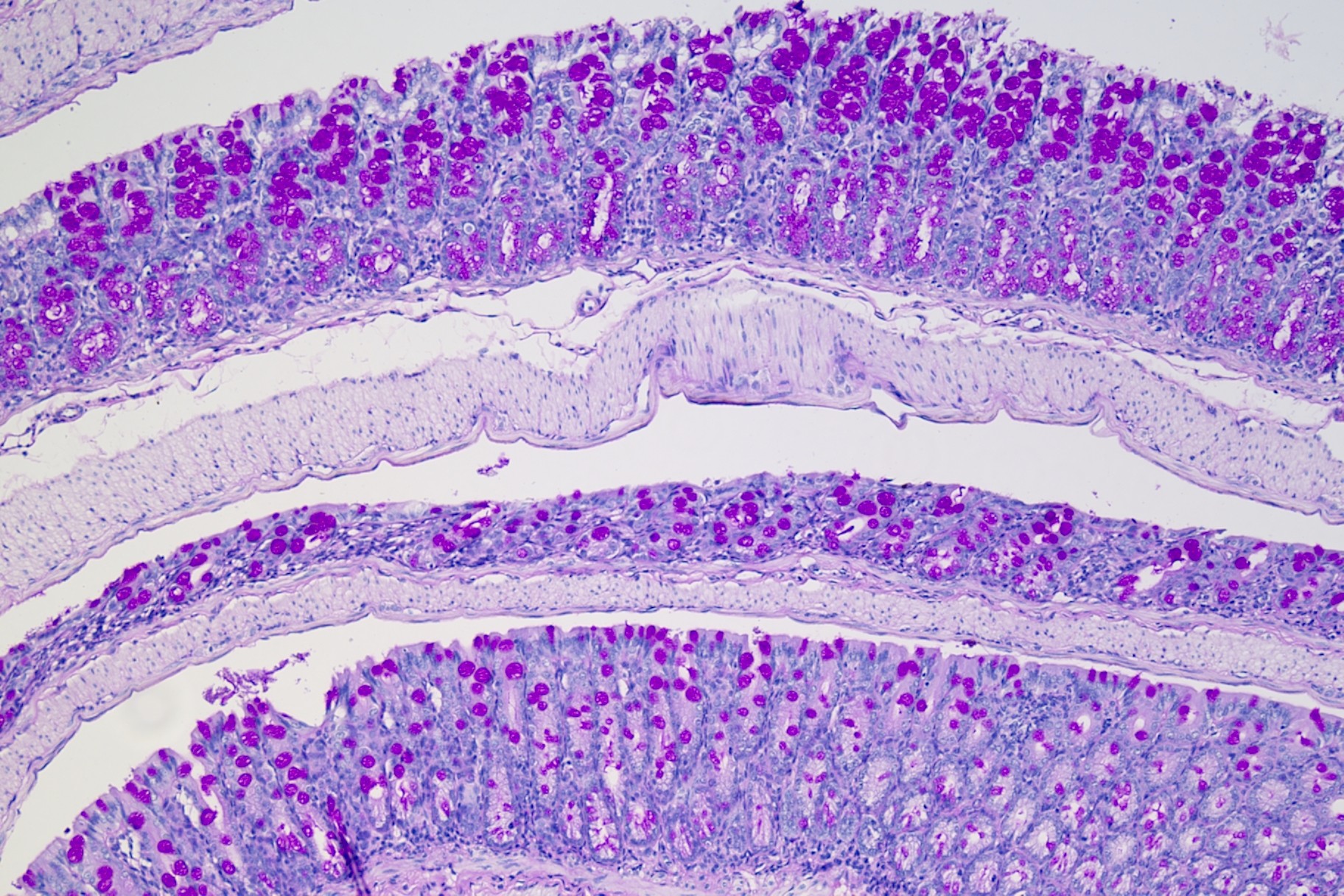
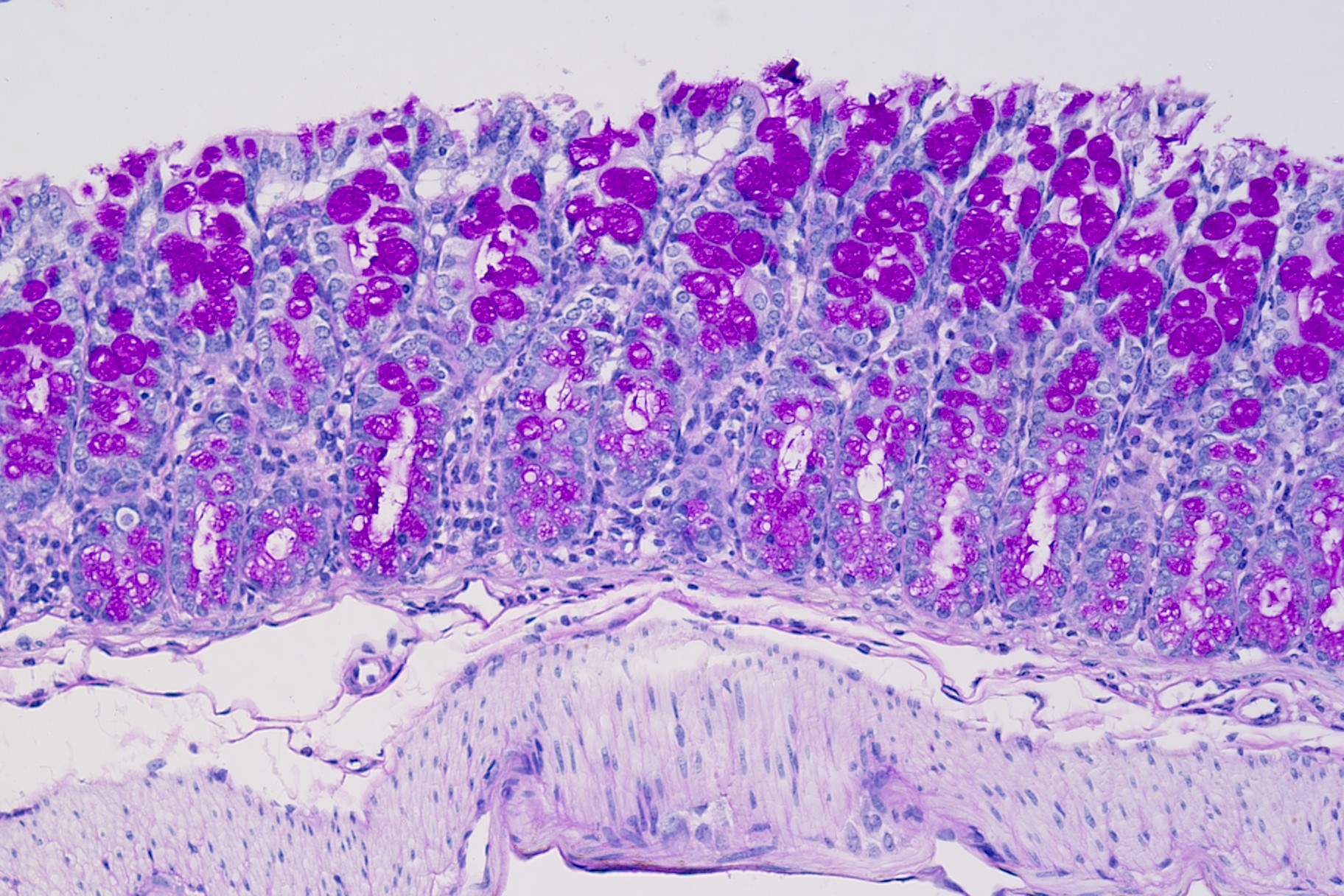
PAS染色法(Periodic Acid-Schiff stain)又称过碘酸雪夫染色,糖原染色。在组织学上,主要用来检测组织中的糖类。过碘酸把糖类相邻两个碳上的羟基氧化成醛基,再用Schiff试剂和醛基反应使呈现紫红色。PAS染色一般用来显示糖元和其它多糖物质。随着医学实验技术的发展,糖原染色应用的范围更加广泛,如用以证明与鉴别细胞内空泡状的性质,心肌病变及其他心血管疾病的诊断,糖原累积病诊断和研究,糖尿病的诊断和研究,用于某些肿瘤的诊断等。除用于糖原的鉴定和黏液的显示外,还可以观察肾小球基底膜、结肠杯状细胞中性黏液物质、阿米巴滋养体和霉菌的着色。为临床诊断、分类和治疗提供了重要的依据。
实验原理
过碘酸能使细胞内的多糖乙二醇基氧化成二醛,再与Schiff氏液的无色品红结合,红色定位于胞浆上。
实验步骤
1. 石蜡切片脱蜡至水(细胞涂片,冰冻切片直接水洗);
2. 蒸馏水洗;
3. 过碘酸酒清夜10min;
4. 自来水冲洗10min;
5. Schiff氏液10min;
6. 流水冲洗5min;
7.Mayer苏木素复染2min,自来水冲洗至细胞核变蓝;
8. 流水冲洗5min;
9. 常规脱水、透明、封固。
结果判读
PAS阳性为红色,细胞核蓝色。
注意事项
1,切片脱蜡应尽量干净,否则影响染色效果。
2,过碘酸氧化时间不宜过久,氧化时的温度以18-22℃最佳。
3,过碘酸溶液和Schiff Reagent应置于4℃密闭保存,使用时避免接触过多的阳光和空气。使用前,最好提前30min取出恢复到室温后,避光暗处使用。
4,酸性乙醇分化液应经常更换新液,其分化时间应该依据切片厚薄、组织类别和酸性乙醇分化液的新旧而定,另外分化后自来水冲洗时间应该足够。
5,过碘酸溶液和Schiff Reagent作用时间非常重要,该依据切片厚薄、组织的类别等决定。
6,冷冻切片染色时间应尽量短。
送检要求
样品类型 | 样本需求 | 保存条件 | 运输条件 |
动物组织 | 单个样品大于0.1g | -80℃ | 干冰 |
种子样本 | 单个样品大于0.2g | -80℃ | 干冰 |
细胞样本 | qPCR/WB:单个样本不少于106个细胞 | -80℃ | 干冰 |
血液样本 | 骨髓1-3ml;用抗凝管保存的外周血5-10ml | -80℃ | 干冰 |
石蜡包埋样本 | 包埋石蜡块大于0.1cm | -20℃ | 冰袋 |
抗体 | 提供足量,并附带抗体说明书 | -20℃ | 冰袋 |
引物 | 如需预实验,引物两对,附带引物合成单 | -20℃ | 冰袋 |
备注:每个样本仅保留唯一且清析可识的标记;邮寄前请与公司专业人员确认方法最佳; | |||

