实验原理
所谓三色染色通常是指染胞核和能选择性的显示胶原纤维和肌纤维。该法染色原理不阴离子染料分子的大小和组织的渗透有关:分子的大小由分子量来体现,小分子量易穿透结构致密、渗透性低的组织;而大分子量则只能进入结构疏松的、渗透性高的组织。然而,淡绿或苯胺蓝的分子量都很大,因此Masson染色后肌纤维呈红色,胶原纤维呈绿色(淡绿)或蓝色(苯胺蓝),主要用于区分胶原纤维和肌纤维。
实验步骤
1. 石蜡切片脱蜡至水。
2. 铬化处理或去汞盐沉淀(甲醛固定的组织此步可略)。
3. 依次自来水和蒸馏水洗。
4. 用Regaud苏木精染液或Weigert苏木精液染核5-10min。
5. 充分水洗,如过染可盐酸酒精分化。
6. 蒸馏水洗。
7. 用Masson 丽春红酸性复红液5-10min。
8. 以2%冰醋酸水溶液浸洗片刻。
9. 1%磷钼酸水溶液分化3-5min。
10. 不经水洗,直接用苯胺蓝或光绿液染5min。
11.以0.2%冰醋酸水溶液浸洗片刻。
12.95%酒精、无水酒精、二甲苯透明、中性树胶封固。
结果判读
胶原纤维、粘液、软骨呈蓝色(如光绿液染色为绿色),胞浆、肌肉、纤维素、神经胶质呈红色,胞核黑蓝色。
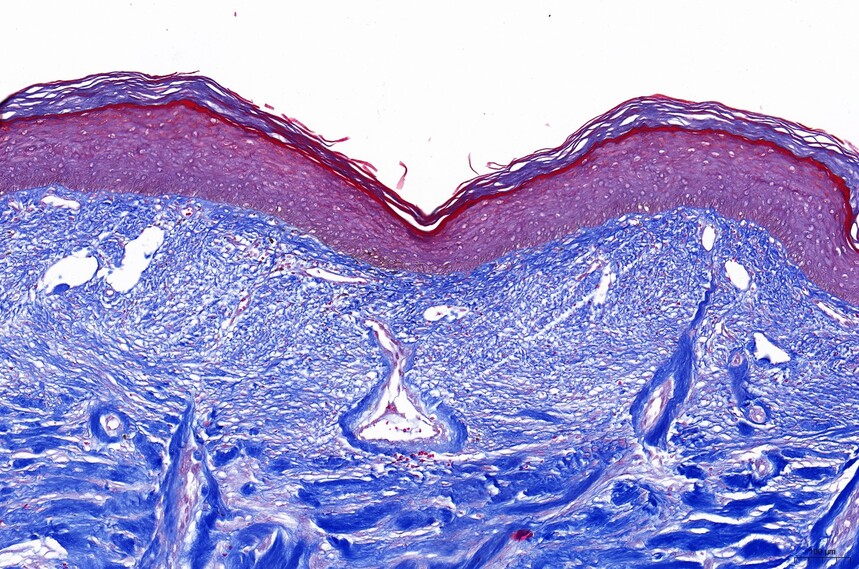
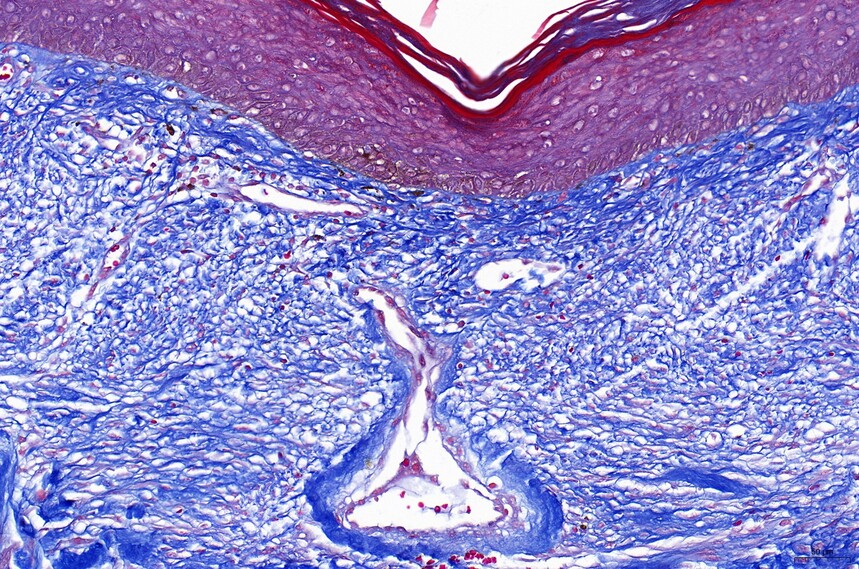
masson-人皮肤(瘢痕)-100X masson-人皮肤(瘢痕)-200X
注意事项
1.控制好染色步骤。
2.组织固定起着很重要的作用,根据不同的固定液可延长或缩短染色时间。
3.0.2%冰醋酸水溶液洗,可使色调清晰鲜艳。
4.磷钼酸水溶液对丽春红、酸性复红有分化作用,分化时镜下控制, 肌纤维和纤维素呈红色,胶原纤维呈淡粉红色即可。
常见问题解析
1、细胞核染色过淡,与细胞质对比差。可能原因包括:①未使用铁苏木精进行细胞核染色,随后的丽春红酸性品红染料去除了细胞核染色;②未使用新鲜配制的铁苏木精,致氧化过度;③细胞核染色时间不足导致染色较弱;④复染分化差,掩盖了细胞核染色。解决方案包括:①避免使用明矾苏木精;②在使用前混合等量的铁苏木精储备溶液,以获得较强的细胞核染色;③确定铁苏木精染色的最佳时间;④确保红色和蓝色复染的正确分化。
2、细胞核染色过深而模糊。可能原因包括:①铁苏木精过染;②铁苏木精染色后洗涤不足。解决方案包括:①确定铁苏木精染色的最佳时间;②铁苏木精染色后用70%乙醇快速冲洗,然后在自来水中彻底清洗。
3、细胞质染色过浅,组织结构不明确。可能原因包括:①长时间水洗;②脱水过程中,在乙醇中停留时间过长;③甲醛固定的组织在染色前未经后固定处理;④使用陈旧的或多次使用的染色试剂;⑤组织自溶或固定延迟,导致组织结构保存不良。解决方案包括:①缩短洗涤时间;②封固前避免在脱水溶液中长时间存放;③甲醛固定的组织在染色前应使用Bouin溶液、苦味酸溶液或氯化汞溶液预处理,以达到所需的媒染效果;④细胞质染料溶液使用不应超过2次。
4、平滑肌纤维未染色或呈灰色而非红色。可能原因包括:①铁苏木精过染,或未结合的铁苏木精去除不充分;②使用陈旧的或多次使用的染色试剂;③甲醛固定的组织在染色前未进行预处理。解决方案包括:①调整铁苏木精染色时间;②铁苏木精染色后使用70%乙醇和水彻底清洗;③及时更换新试剂;④甲醛固定的组织在染色前用Bouin溶液、苦味酸溶液或氯化汞溶液进行预处理,以达到所需的媒染效果。
5、组织结构呈现错误的染色或染色不均匀。可能原因包括:①甲醛固定的组织在染色前未经后固定;②组织分化不当;③1种或多种染色液的pH值不正确;④在乙酸溶液中清洗不当。解决方案包括:①甲醛固定的组织在染色前应使用Bouin溶液、苦味酸溶液或氯化汞溶液后固定,以达到所需的媒染效果;②正确的分化,要求染色过程中每个步骤时间准确,避免在乙酸溶液中长时间洗涤,以防止去除所需结构上的染料;③验证染料溶液的pH值是否为2.5或更低。
送检要求
样品类型 | 样本需求 | 保存条件 | 运输条件 |
动物组织 | 单个样品大于0.1g | -80℃ | 干冰 |
种子样本 | 单个样品大于0.2g | -80℃ | 干冰 |
细胞样本 | qPCR/WB:单个样本不少于106个细胞 | -80℃ | 干冰 |
血液样本 | 骨髓1-3ml;用抗凝管保存的外周血5-10ml | -80℃ | 干冰 |
石蜡包埋样本 | 包埋石蜡块大于0.1cm | -20℃ | 冰袋 |
抗体 | 提供足量,并附带抗体说明书 | -20℃ | 冰袋 |
引物 | 如需预实验,引物两对,附带引物合成单 | -20℃ | 冰袋 |
备注:每个样本仅保留唯一且清析可识的标记;邮寄前请与公司专业人员确认方法最佳; | |||

