实验原理
TUNEL染色是检测细胞凋亡染色的常见方法,其原理是细胞在发生凋亡时,会激活一些DNA内切酶,这些内切酶会切断核小体间的基因组DNA。细胞凋亡时抽提DNA进行电泳检测,可以发现180~200bp的DNA ladder。基因组DNA断裂时,暴露的3'-OH可以在末端脱氧核苷酸转移酶(Terminal Deoxynucleotidyl Transferase, TdT) 的催化下加上荧光素、生物素标记的dUTP,从而可以通过荧光显微镜或化学显色方法检测细胞凋亡的情况。
实验步骤
1.组织脱水:梯度酒精对组织进行脱水处理,75%酒精(4h)-85%酒精(2h)-90%酒精(1.5h)-95%酒精(1h)-无水乙醇I(0.5h)-无水乙醇Ⅱ(0.5h);
2.组织透明:组织块经酒精脱水后必须经过透明。透明剂(二甲苯)能同时与脱水剂和石蜡混合,它取代了脱水剂后,石蜡便能顺利地渗入组织,无水乙醇:二甲苯(1:1)(10min)-二甲苯Ⅰ(10min)-二甲苯Ⅱ(10min);
3.浸蜡:透明后的组织块依次经3缸石蜡(60℃)进行浸蜡,石蜡Ⅰ(60℃)(1h)-石蜡Ⅱ(60℃)(1h)-石蜡Ⅲ(60℃)(1h);
以上3个实验步骤都在生物组织脱水机里面完成(机器自动程序)
4.包埋:包埋是使浸透蜡的组织块包裹在石蜡块中。包埋用蜡的温度应略高于浸蜡温度,保证组织块与包埋石蜡完全融为一体。
5.切片和烤片:包埋好的蜡块使用徕卡病理切片机进行切片,切好的组织片放入40℃的水浴锅中进行摊片,防脱玻片倾斜着插入水面去捞取切片,使切片贴附在载玻片的合适位置,于60℃ 烤箱烤片3个小时即可。
6.切片脱蜡:将石蜡切片依次放入二甲苯Ⅰ(20min)-二甲苯Ⅱ(20min)-二甲苯Ⅲ(20min)-无水乙醇Ⅰ(5min)-无水乙醇Ⅱ(5min)-95%酒精(5min)-90%酒精(5min)-80%酒精(5min)-70%酒精(5min),然后蒸馏水浸洗5min。
7.用去离子水轻轻润洗切片,并用滤纸小心吸干玻片上样本周围多余的液体。用油性笔在组织周围描绘组织分布的轮廓,便于下游透性处理和平衡标记操作。在实验过程中,切勿让组织干燥,处理好的样本放在湿盒中保持样本的湿润。
8.按1:100的比例,用去离子水作为稀释液来稀释2mg/ml的Proteinase K溶液,使其终浓度为20μg/ml。每个样本上滴加100μl浓度为20μg/ml的Proteinase K溶液,使其被全部覆盖,室温孵育20min。
9.用去离子水溶液润洗样本,轻轻去掉多余液体,并用滤纸小心吸干载玻片上样本周围的液体。处理后的样本放在湿盒中保存样本的湿润。
10. 按1:5的比例用去离子水稀释5×Equilibration Buffer。每个样本滴加100μl 1×Equilibration Buffer使其全部覆盖待检样本区域,室温孵育15分钟。在平衡细胞的同时在冰上解冻BrightRed Labeling Mix,并且依照表1,准备足够量的用于所有实验的和可选阳性对照反应的TdT孵育缓冲液。
表1.准备用于实验的和可选阳性对照反应的TdT孵育缓冲液
组分 | 体积 |
ddH2O | 34 |
5×Equilibration Buffer | 10 |
BrightRed Labeling Mix | 5 |
Recombinant TdT Enzyme | 1 |
11.在平衡后的区域周围用吸水纸洗掉100μl 1×Equilibration Buffer中的大部分,然后在组织上加入TdT孵育缓冲液,不要让组织干片。把塑料盖玻片盖在组织上以保证试剂的平均分布,在湿盒的底部放上用水浸湿的纸巾。将载玻片置于湿盒内,在37℃孵育60min。然后用PBS洗涤3次,每次5min 。
12.复染核:滴加DAPI避光孵育5min,对标本进行染核,PBST 5min×4次洗去多余的DAPI。
13.用吸水纸擦干切片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
结果判读
凋亡细胞呈红色或者绿色(因荧光素不同而不同),细胞核呈蓝色。

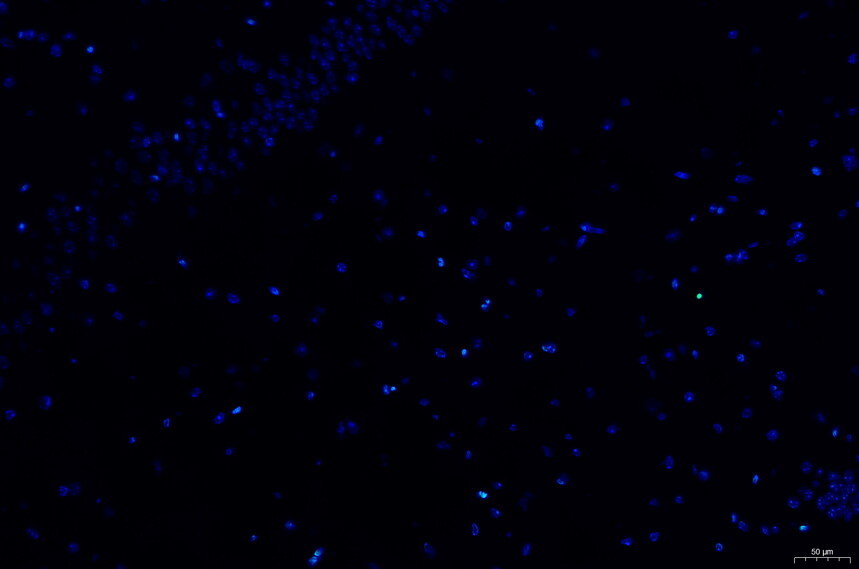
tunel(荧光)-小鼠脑-50X tunel(荧光)-小鼠脑-200X
注意事项
1、 出现非特异性荧光标记:组织或细胞未充分固定;使用了不适当的固定液; TUNEL反应时间过长,或反应液渗漏。
2、荧光背景高:支原体污染片;细胞核中的DNA断裂;TUNEL反应过强,红细胞中血红蛋白导致的自发荧光产生严重干扰。
3、标记效率低:使用甲醇或乙醇固定,固定时间过长;未避光操作。
常见问题解析
1.为什么设置阳性组、阴性组
阳性组:用来验证本次实验操作和试剂盒有无问题。
阴性组:a.排除细胞自身凋亡以及操作过程等原因导致的非特异性染色;b.调整拍摄曝光强度。
除此以外,大家或多或少会遇到染色结果异常,包括荧光信号弱、没有荧光信号、假阳性高、荧光背景强等问题。染色失败的原因主要包括样本处理不当、染色不充分、曝光时间过长等,可从以下几个方面对症分析。
2. 荧光信号弱或没有荧光信号
若已知细胞或者组织样本处于细胞凋亡状态,但是用TUNEL检测发现荧光信号偏弱或没有信号。
2.1样本处理不当
1)样本切片太厚。建议适当将切片切薄一点,便于染色。
2)脱蜡和水化不充分。建议脱蜡先60 ℃ 20 min,再使用二甲-苯两次5-10 min;而水化用梯度乙醇从高到低浓度浸洗。
3)Proteinase K的孵育时间过短。优化Proteinase K的孵育时间,常用时间10-30 min。4 μm左右的片子孵育10 min,30μm左右的片子孵育30 min。
4)Proteinase K浓度过低。建议蛋白酶K一般工作液浓度为20 μg/mL。
5)放置在-20 ℃保存较长时间的切片不新鲜,减低染色效率。建议使用新鲜切片。
2.2染色操作不当
1)染色时间过短。建议一般 37℃ 孵育60 min,可以根据凋亡损伤程度,可长至2 h,但要结合背景着色。
2)TdT酶或荧光素/酶标记的dUTP浓度过低。建议适当提高TdT酶或荧光素/酶标记的dUTP浓度。
3)TdT酶失活。建议TUNEL反应液临用前配制,短时间在冰上保存。不宜长期保存,长期保存会导致TdT酶失活。
4)样本干燥。加上TUNEL反应液后,请盖上盖玻片/保鲜膜/湿盒中进行,保证样本均匀染色,又可防止反应液干燥。
2.3荧光检测操作不当
操作未避光。由于荧光易碎灭,建议标记与检测样本时,载玻片要避光,观察时要尽量快。
3.非特异性染色(假阳性高)
若已知细胞或者组织样本依然处于活细胞状态,但是用TUNEL试剂盒检测,出现了非特异性染色,和处理过的荧光信号一样强,甚至比阳性对照组荧光信号还要强。
3.1样本处理不当
1)使用酸性或碱性固定液,导致DNA损伤。建议使用pH中性的固定液固定组织或者细胞。
2)固定液浓度过高,导致细胞自溶、DNA链不规则断裂、造成假阳性。建议使用4%多聚甲-醛溶液(溶于PBS)。
3)固定时间过长,导致细胞自溶、DNA链不规则断裂、造成假阳性。建议控制固定时间在4 ℃放置25 min。
4)蛋白酶K处理时间过长,破坏核酸结构,出现假阳性。建议适当缩短处理时间。
5)蛋白酶K浓度过大,破坏核酸结构,出现假阳性。建议适当调整蛋白酶 K溶液浓度,一般工作液浓度为20 μg/mL。
3.2 染色操作不当
1)TUNEL染色时间过长。建议一般是 37℃ 孵育60 min,可以根据凋亡损伤程度,可长至2 h,但要结合背景着色。
2)未充分清洗样本。染色后PBS清洗次数可增加到5次,来避免切片的非特异性染色。
4.荧光背景强
4.1染色操作不当
1)TUNEL染色时间过长。建议染色时间适当,一般是 37 ℃ 孵育60 min,避免串色。
2)TUNEL染色液浓度过大。建议增大稀释倍数,优化浓度。
3) 使用试剂盒提供的二价阳离子优化反应,试剂盒中的Mg2+可降低背景,Mn2+可增强染色效果。
4)PBS未充分清洗样本。在TUNEL反应后PBS清洗次数可增加到5次,来避免切片样本中残留的染料。
4.2荧光检测操作不当
曝光时间过长。建议调整曝光条件,先对阴性组调整到无背景光,然后用这个曝光条件去拍摄实验组(可以微调,但是不需要大调)。
送检要求
样品类型 | 样本需求 | 保存条件 | 运输条件 |
动物组织 | 单个样品大于0.1g | -80℃ | 干冰 |
种子样本 | 单个样品大于0.2g | -80℃ | 干冰 |
细胞样本 | qPCR/WB:单个样本不少于106个细胞 | -80℃ | 干冰 |
血液样本 | 骨髓1-3ml;用抗凝管保存的外周血5-10ml | -80℃ | 干冰 |
石蜡包埋样本 | 包埋石蜡块大于0.1cm | -20℃ | 冰袋 |
抗体 | 提供足量,并附带抗体说明书 | -20℃ | 冰袋 |
引物 | 如需预实验,引物两对,附带引物合成单 | -20℃ | 冰袋 |
备注:每个样本仅保留唯一且清析可识的标记;邮寄前请与公司专业人员确认方法最佳; | |||

