实验原理
鬼笔环肽结合F-肌动蛋白,防止其解聚并中毒细胞。 鬼笔环肽特异性结合在F-肌动蛋白亚基之间的界面,将相邻的亚基锁定在一起。 鬼笔环肽(一种双环七肽)与肌动蛋白丝的结合比与肌动蛋白单体的结合更紧密,从而导致肌动蛋白亚基从丝端解离的速率常数减小,这通过防止丝解聚而基本稳定了肌动蛋白丝。此外,发现鬼笔环肽抑制F-肌动蛋白的ATP水解活性。因此,鬼笔环肽以不同于G-肌动蛋白的构型捕获肌动蛋白单体,并通过大大降低单体解离的速率常数来稳定F-肌动蛋白的结构,这是与ADP捕获有关的事件。 总体而言,发现鬼笔环肽与肌动蛋白发生化学计量反应,强烈促进肌动蛋白聚合并稳定肌动蛋白聚合物。
鬼笔环肽在细胞中不同浓度下的功能不同。 当鬼笔环肽以低浓度引入细胞质时,它将聚合度较低的细胞质肌动蛋白和纤维蛋白吸收到稳定的聚集的肌动蛋白聚合物“岛”中,但不会干扰应力纤维,即厚的微丝束。Wehland等 还注意到在更高的浓度下,鬼笔环肽会诱导细胞收缩。
实验步骤
1)细胞爬片生长>24h,使其密度达到50~60%汇合度。
2)吸掉培养液,37℃预热的1×PBS(pH 7.4)清洗细胞2次。
3)使用溶于PBS的4%甲醛溶液进行细胞固定,室温固定10~30min。
4)室温条件下,用PBS清洗细胞2~3次,每次10min。
5)室温条件下,用丙酮(≤-20℃)脱水或者用0.5% Triton X-100溶液透化处理5min。
6)室温条件下,用PBS清洗细胞2~3次,每次10min。
7)取配制好的 TRITC标记鬼笔环肽工作液,覆盖住盖玻片上的细胞,室温避光孵育30min(通常情况下,4℃~37℃孵育皆可)。
8)用PBS清洗盖玻片3次,每次5min。
9)使用即用型DAPI溶液(浓度:100 nM)对细胞核进行复染,约30s。
10)用PBS清洗盖玻片,然后倒置在已经滴有一滴Fluoromount-GTM 水溶性封片剂的载玻片上。使用纸巾轻轻檫掉多余封片剂,然后用指甲油永久封片。此法制备的标本玻片可置于4℃避光保存,通常6个月内可继续做F-actin染色分析。
11)荧光显微镜或者共聚焦显微镜下进行荧光观察,选择 TRITC 激发/发射滤片(Ex/Em=545/570 nm)和 DAPI 激发/发射滤片(Ex/Em=364/454 nm)
结果判读
细胞微丝呈红色或者绿色,细胞核呈蓝色
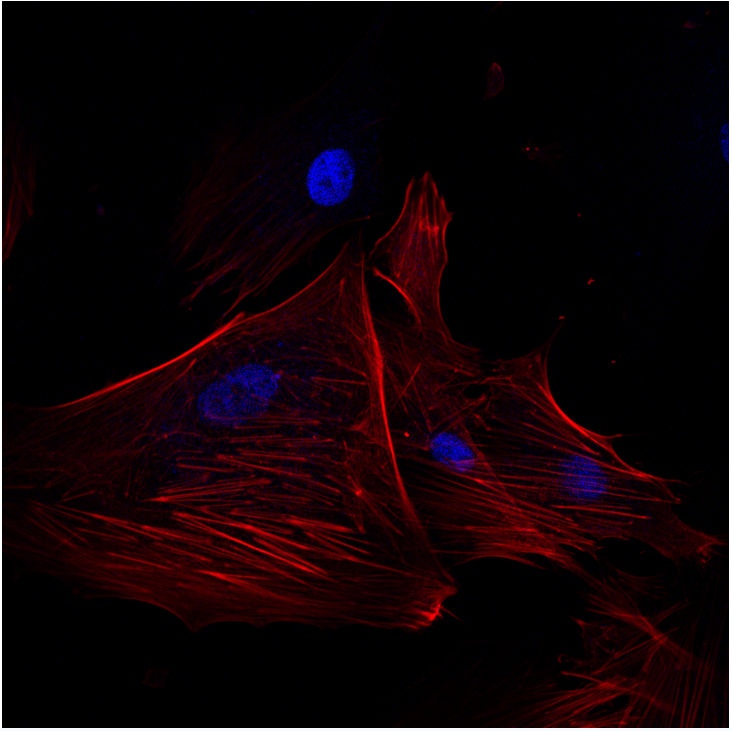
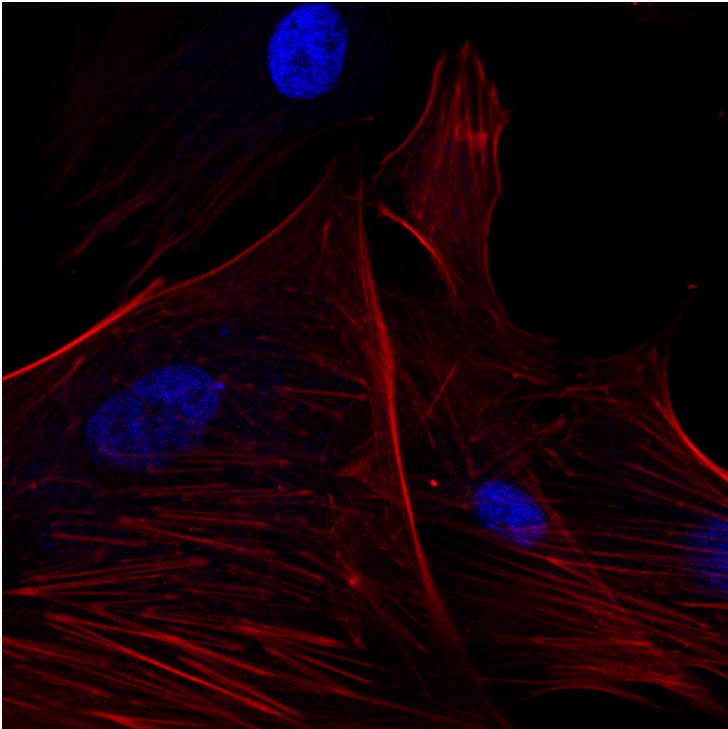
共聚焦拍照-人牙龈成纤维细胞-鬼笔环肽染色-1000X 共聚焦拍照-人牙龈成纤维细胞-鬼笔环肽染色-1000X
注意事项
1、毒性较大,戴上手套操作。
2、避免固定剂中含有甲醇成分,因为甲醇在固定过程中可能破坏肌动蛋白。
3、为了降低背景,可于TRITC标记的鬼笔环肽工作液内加入1% BSA;另外,孵育过程中为了避免溶液挥发,可将盖玻片转移到一个密封的容器内。
常见问题解析
1:鬼笔环肽染色可以在活细胞中进行吗?
A:鬼笔环肽的染色需要对样品进行固定和透化,帮助鬼笔环肽和F-actin的结合,得到更好的染色效果。
2:我的细胞样品转染了带有GFP的质粒,我应该选择哪一款鬼笔环肽?
A:可以选择TRITC(橙色),iFluorTM 555(橘色)或是iFluorTM 647(远红)标记的鬼笔环肽。
3:染色贴壁细胞,每个样品大概需要多少工作液?
A:染色贴壁细胞只需要染色工作液能够完全覆盖细胞即可。
4:几种不同的鬼笔环肽的区别是什么,如何选择?
A:是荧光基团的不同,激发出的荧光颜色不同,用于区分共染时其他荧光染料的荧光颜色,对于选择需要机器满足激发和发射波长要求。
5:鬼笔环肽染色存在种属区分吗?
A:对于动物活细胞染色,不区分种属。
送检要求
样品类型 | 样本需求 | 保存条件 | 运输条件 |
动物组织 | 单个样品大于0.1g | -80℃ | 干冰 |
种子样本 | 单个样品大于0.2g | -80℃ | 干冰 |
细胞样本 | qPCR/WB:单个样本不少于106个细胞 | -80℃ | 干冰 |
血液样本 | 骨髓1-3ml;用抗凝管保存的外周血5-10ml | -80℃ | 干冰 |
石蜡包埋样本 | 包埋石蜡块大于0.1cm | -20℃ | 冰袋 |
抗体 | 提供足量,并附带抗体说明书 | -20℃ | 冰袋 |
引物 | 如需预实验,引物两对,附带引物合成单 | -20℃ | 冰袋 |
备注:每个样本仅保留唯一且清析可识的标记;邮寄前请与公司专业人员确认方法最佳; | |||

