实验原理
即抗原与抗体特异性结合的原理,用标记的特异性抗原(抗体)对组织内抗体(抗原)的分布进行检测的研究,简单说其本质是带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的呈色反应,对相应抗原进行定性、定位、定量测定的一项技术。通过抗原抗体反应及呈色反应,显示细胞或组织中的化学成分,在显微镜下可清晰看见细胞内发生的抗原抗体反应产物,从而能够在细胞或组织原位确定某些化学成分的分布、含量。组织或细胞中凡是能作抗原或半抗原的物质,如蛋白质、多肽、氨基酸、多糖、磷脂、受体、酶、激素、核酸及病原体等都可用相应的特异性抗体进行检测。
实验步骤
1. 洗载玻片:将载玻片置于重铬酸钾和浓H2SO4混合液中,目的是为了是载玻片上的硅胶等除去,同时使一些肉眼看不见的凹凸不平的表面变平整,便于组织吸附,然后置于清水中清洗,除去残余的重铬酸钾和浓H2SO4(大约冲一个小时左右),再将载玻片浸泡于酒精之中,然后放到架子上,置于37°C温箱中,将多聚赖氨酸涂布于玻片的表面,由于Lys带正电,而大多数的组织带负电荷,从而产生吸附作用。
2.包埋组织:先在铁模具中加入一些液态石蜡,先稍微冷却,然后再将待包埋的组织置于石蜡之中,并排列整齐,再将塑料模具盒盖上,最后加入少许液体石蜡,进行冷冻,使石蜡变成固态。
3.切片:将包埋好的组织从模具上取下来,并置于石蜡切片机上,切片机通过调节上下左右来来使组织和切割方向一致,然后调节切片的厚度,一般为 5μm,如果比较难切,则可以适当调整厚度,用毛笔将切割的载玻片向外拉,并用小镊子将包含有完整组织的载玻片置于40°C温水中。
4.捞组织:当组织载玻片置于40°C温水中之前,要先将水浴中的气泡赶走,以免气泡受热上浮而贴到组织上,组织受热展开,最好是组织不起皱纹,用载玻片捞组织时,一般取载玻片的下1/3或者下1/2一般每种组织捞5-6张,其中2-3张是备用的,每张载玻片上通常捞两份组织,做对照使用,这样形成的误差就比较小了,而且捞载玻片的时候最好方向一致,以便观察,再将捞出来的载玻片置于架子上,放入37°C温箱中烘干。
5.脱蜡:依次将载玻片放入二甲苯-二甲苯-100%酒精-100%酒精-95%酒精-90%酒精-80%酒精-70%酒精,起脱蜡作用的主要是二甲苯, 依据的是相似相溶的原理。一般在每个试剂中放10min,天气热可以少放几分钟,相反,天气较冷的话,就要适当延长脱蜡时间,一般为12-15min。
6.抗原修复:我们采用电陶炉进行抗原修复,将脱蜡水化后的组织切片置于烧杯(或修复盒)中的耐高温塑料切片架上,加适量的修复液(0.01M枸橼酸缓冲液,pH6.0)于烧杯中,液面要浸过切片组织一定高度,电陶炉可先用高档加热使液体沸腾,当加热至沸腾时调到中档,此时开始计时,修复时间为15min,此过程中勿使组织干片(修复液要足量)。到时间后将烧杯从电陶炉中取下,自然冷却,当修复液降至室温后取出玻片,用PBS(PH7.4)冲洗3遍,每次3min(冲洗过程中切勿对着组织冲洗,以免弄破组织)。
7.阻断内源性过氧化物酶:将配制好的3%的过氧化氢滴加于切片组织上以阻断内源性过氧化物酶,室温孵育15min,PBS冲洗3次,每次3min。
8.血清封闭:冷却至室温后,将柠檬酸缓冲液倒掉,水洗2次,并将载玻片置于PBS中5min,洗2次,擦干组织周围的PBS液,马上加上血清,使一些非特异性的位点封闭起来,然后放入37°C温箱中半小时。血清稀释10倍(900μlPBS:100μl血清封闭液)。
9.加一抗:将温箱中的载玻片取出,用吸水纸擦干载玻片反面和正面组织周围的血清,加一抗,如果做对照实验,就在对照的组织上加PBS。加完一抗后于4°C冰箱中保存过夜。
10.加二抗:将载玻片从冰箱中取出,放入PBS中洗3次,每次5min,擦干组织周围的PBS后加上二抗,然后置于37°C温箱中半小时。
11. 加显色剂:将片子从温箱中取出, 放入PBS中洗3次,每次5min,擦干组织周围的PBS后加上显色剂。(显色剂的配置:在1ml水中加1滴显色剂A,摇匀,然后加1滴显色剂B,摇匀, 再加1滴显色剂C,摇匀) A:DAB B:H2O2 C:磷酸缓冲液
12. 复染:将显色后的片子用清水冲洗一段时间后,浸泡于苏木精中染色,一般动物组织为半分钟,植物组织3-5min。
13. 脱水:将复染后的片子置于水中冲洗后,依次将载玻片放入70%酒精-80%酒精-90%酒精-95%酒精-100%酒精-100%酒精-二甲苯-二甲苯。每个试剂中放置2min,最后浸泡在二甲苯中,搬到通风柜中。
14. 封片:用中性树胶滴在组织旁边,再用盖玻片盖上,要先放平一侧,然后轻轻放下另一侧,以免产生气泡,封好片子后置于通风柜中晾干。
结果判读
目的蛋白呈棕黄色,细胞核呈蓝色。
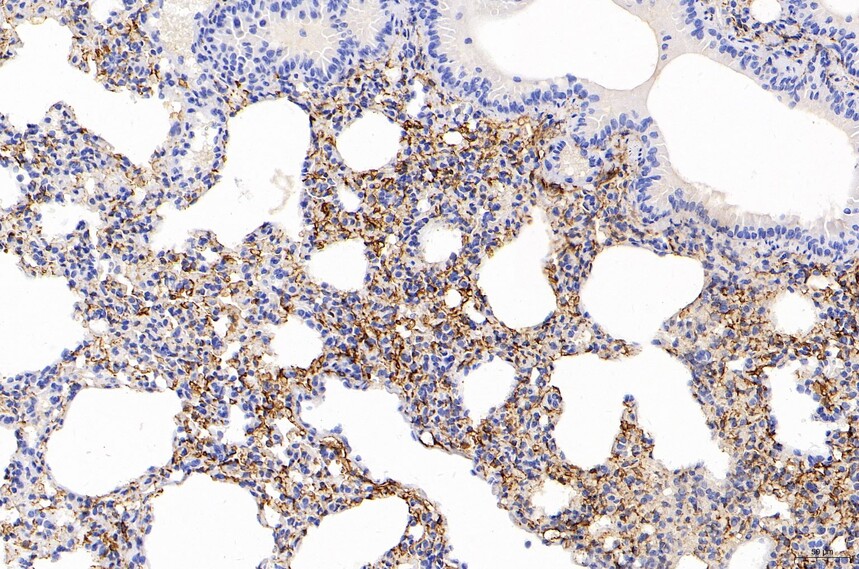
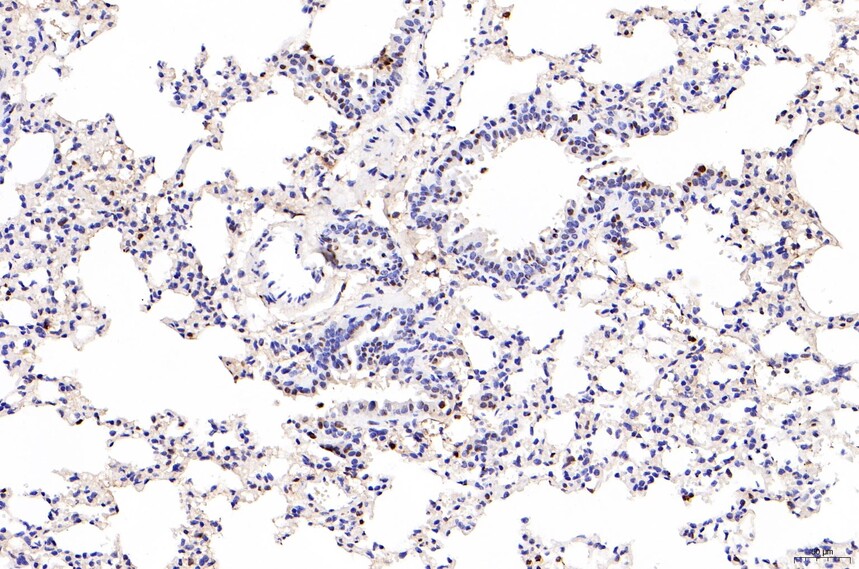
注意事项
1.固定:最好用4%的多聚甲醛固定液。对于冰冻切片,甲醛固定有时比冰冻丙酮好;但对于不同的组织和抗原,可选用不同的固定液。
2.组织脱水,透明:时间不能太长,否则在切片时容易碎片,切不完整。
3.切片时展片: 有些组织在切片后难以在水中展开,这时可适当地在水中加入几滴乙醇。
4.烤片: 60℃ 30分钟或37℃ 过夜,温度太高或时间太长,抗原容易丢失。
5.蜡块及切片的保存: 最好在4℃保存。
6.脱片问题:Poly-L-Lysine(多聚赖氨酸)为目前免疫组化 染色工作中最常用的一种防脱片剂,6ml的多聚赖氨酸溶液可按1:10稀释成60ml的工作液,适合于需要酶消化、微波、高温高压的防脱片处理。如不行,可用双重处理(APES和Poly-L-Lysine)的切片。在以上两种条件都行不通的情况下,可用如下方法:切片在脱蜡前,放在APES 1:50 丙酮溶液中浸泡3分钟,晾干,即可进行下一步。
7.灭活内源性酶: HRP系统:3%双氧水灭活;AP系统:3%HAc灭活。
8.暴露抗原:对于石蜡切片的免疫组化实验时,必须采用高温加热抗原修复,这将有助于暴露抗原决定簇,从而增加免疫组化染色的强度。对于不同的组织,不同的抗原,不同的抗体,所采用的方法应不一样,可进行热修复、胰酶消化、既不修复也不消化。胶原还可以用胃蛋白酶消化等。
9.封闭:在山羊血清封闭,非特异性染色仍然较强时,可延长封闭时间或用浓缩血清封闭
10.抗体稀释: 应遵循“现用现配”的原则,对于PBS稀释的抗体一定要当天使用。
11.背景高: 在抗体浓度、反应时间、反应温度等合适的条件下,如果背景依旧高,可采用含1‰ Tween20的PBS洗,特别是在显色之前要多洗。
12.返蓝: 在苏木素复染后,可用碱性缓冲液(如PBS)或Na2HPO4的饱和溶液返蓝。
13.显色: 一定要在显微镜下观察,注意控制背景。
14.在整个操作过程中,切片千万不能干燥,否则会有非特异性染色。
常见问题解析
1) 产生组织切片非特异性染色的原因有哪些?如何解决?
1、 抗体孵育时间过长、抗体浓度高易增加背景着色。这可通过缩短一抗/二抗孵育时间、稀释抗体来控制。这是最重要的一条。
2、 一抗用多克隆抗体易出现非特异性着色,建议试用单克隆抗体看看。
3、内源性过氧化物酶和生物素在肝脏、肾脏等组织含量很高(含血细胞多的组织),需要通过延长灭活时间和增加灭活剂浓度来降低背景染色;
4、非特异性组分与抗体结合,这需要通过延长二抗来源的动物免疫血清封闭时间和适当增加浓度来加强封闭效果;
5、 DAB 孵育时间过长或浓度过高;
6、 PBS 冲洗不充分,残留抗体结果增强着色,在一抗/二抗/SP 孵育后的浸洗尤为重要;
7、 标本染色过程中经常出现干片,这容易增强非特异性着色。
2) 免疫组化染色呈阴性结果的原因有哪些?
1、抗体浓度和质量问题以及抗体来源选择错误。不是抗体浓度越高就越易出现阳性结果,抗原抗体反应有前带和 后带效应,必须摸索最佳浓度。
2、抗原修复不全,对于甲醛固定的组织必须用充分抗原修复来打开抗原表位,以利于与抗体结合;建议微波修复 用高火 4 次×6min 试试。
3、组织切片本身这种抗原含量低。
4、血清封闭时间过长。
5、DAB 孵育时间过短。
6、细胞通透不全,抗体未能充分进入胞内参与反应。
3) 石蜡切片和冰冻切片的比较?
1、要求做冰冻切片的不一定能做石蜡切片。因为做石蜡切片时要高温烤片,可能会破坏组织的抗原性,如果组织 的抗原性较稳定,则可作石蜡切片;但是要求做石蜡切片的,可作冰冻切片。
2、冰冻切片的优点是能够较好的保存组织的抗原免疫活性,做免疫组化时不需抗原修复这一步。缺点是细胞内易 形成冰晶而破坏细胞结构,可能会使抗原弥散。
3、石蜡切片的优点可以保持组织细胞的形态结构,且容易存放在室温,而冰冻切片比较麻烦,一定要存在-80 ℃的低温冰箱中,尤其是用来做原位杂交的的切片,为了防止RNA降解,保存一贯很重要。由于石蜡切片可以切到 4 微米左右,所以原位杂交探针容易渗透到组织中去,容易成功,而且得到的颜色/形态都较冰冻切片好。
4) 如何选择一抗?
1、单克隆和多克隆抗体的选择。由一种克隆产生的特异性抗体叫做单克隆抗体。单克隆抗体能目标明确地与单一 的特异抗原决定簇结合,就像导弹精确地命中目标一样。另一方面,即使是同一个抗原决定簇,在机体内也可以由 好几种克隆来产生抗体,形成好几种单克隆抗体混杂物,称为多克隆抗体。在抗原抗体反应中,一般单克隆抗体特 异性强,但亲和力相对小,检测抗原灵敏度相对就低;而多克隆抗体特异性稍弱,但抗体的亲和力强,灵敏度高,但易出现非特异性染色(可以通过封闭等避免)。
2、应用范围的选择。有的一抗只能用于 Western blotting,或免疫组化、免疫荧光、免疫沉淀等;甚至标明石蜡切片或冰冻切片。
3、种属反应性的选择(species reactivity)。这一点很重要,表明这种抗体可能存在种属差异,且这种抗体适合检测哪种种属动物体内的抗原。
4、种属来源,一般兔来源的多是多克隆抗体;而小鼠来源的多是单克隆抗体,但也有另外。根据此来源来选择相应的二抗。
5) 在什么情况下使用 TritonX-100?
1、Triton X-100 化学名称为聚乙二醇辛基苯基醚,是一种去污剂。在免疫组织化学(>10um 厚切片) 和免疫细胞化学中一般用 Triton X-100 作为细胞通透剂,在膜上打孔。
2、其作用原理:Triton X-100 可以溶解细胞膜、细胞核膜、细胞器膜上的脂质而使抗体及大分子结构的物质进入胞浆和胞核内,故在细胞免疫组化时尤为推荐使用,这样抗体就能顺利进入胞内与相应抗原结合。
3、Triton X-100 既是一种表面活性剂,也有抗氧化作用。
6) 封闭血清的选择原则是什么?
1、膜上或切片上有剩余的位点可以非特异性吸附抗体,造成后续结果的假阳性。
2、封闭血清一般是和二抗同一来源的,血清中动物自身的抗体,预先能和组织中有交叉反应的位点发生结合,否则在后面的步骤中如果和二抗发生结合,会造成背景。
3、也可以用小牛血清、BSA、羊血清等,但不能与一抗来源一致。
7) 抗体孵育条件的比较?
1、一抗孵育温度有几种:4℃、室温、37℃,其中 4℃效果最佳;孵育时间:这与温度、抗体浓度有关,一般 37℃1-2h,4℃过夜(从冰箱拿出后 37℃复温 45min)。
2、二抗一般室温或 37℃ 30min-1h,具体时间需要摸索。
8) 一抗 4 ℃孵育后为什么要进行 37 ℃复温?
1、一方面,防止切片从 4 ℃直接放入 PBS 易脱片;
2、另一方面,使抗原抗体结合更稳定。一般不需要,但对表达较弱的抗原可能有用,4℃和 37℃时分子运动方式不同, 前者分子碰撞机率和运动速度小于后者,后者结合更快,但敏感性也提高了并易造成非特异染色。
9) DAB 显色时间如何把握?
1、DAB 显色时间不是固定的,主要由显微镜下控制显色时间,到出现浅棕色本底时即可冲洗;
2、DAB 显色时间很短(如几秒或几十秒)就出现很深的棕褐色,这很可能说明你的抗体浓度过高或抗体孵育时间过长,需要下调抗体浓度或缩短你的抗体孵育时间;
3、此外,若很短时间就出现背景很深,还有可能是前面的封闭非特异性蛋白不全,需要延长封闭时间;
4、DAB 显色时间很长(如超过十几分钟)才出现阳性染色,一方面可能说明你的抗体浓度过低或孵育时间过短(最好一抗4℃过夜);另一方面就是封闭时间过长。
10) 免疫组化结果如何分析?
1、阳性着色细胞计数法。光镜下,随机选择不重叠的10个视野,人工或机器计数阳性着色细胞,每组3~6张不同动物组织切片,然后进行组间比较即可。
2、灰密度分析法。通过在不同组别和不同动物组织切片上选择相同区域、相同条件下用 image j 进行灰密度分析, 然后进行统计分析即可。
3、评分法。通过在光学显微镜下对组织切片分别按染色程度(0~3 分为阴性着色、淡黄色、浅褐色、深褐色)、阳性范围进行评分(1~4 分为 0~25%、26~50%、51~75%、76~100%),最终可以分数相加,再进行比较。
11) 在什么情况下进行组织抗原修复?
1、由于组织中部分抗原在甲醛或多聚甲醛固定过程中,发生了蛋白之间交联及醛基的封闭作用,从而失去抗原性。 通过抗原修复,使得细胞内抗原决定族重新暴露,提高抗原检测率。
2、修复方法从强到弱一般分为三种,高压修复、微波修复、胰酶修复。修复液也分为若干种。
3、微波修复,一般用 6min×4 次。
12) 内源性过氧化物酶的灭活时间和浓度是什么?
1、一般3%过氧化氢灭活时间短点,可以10min左右;而 0.3%过氧化氢则可以适当延长封闭时间,一般10~30min。
2、用甲醇配置过氧化氢比双蒸水或PBS可能好在保护抗原和固定组织作用,过氧化氢孵育时间过长易引起脱片.
3、现用现配,配好后 4 度避光保存。
13) 如何才能充分脱蜡?
1、蜡不溶于水,如果脱蜡不干净,少许蜡存留于切片上,将会引起染色不均匀、阳性物时隐时现、真假难辨、背景染色增加等。
2、脱蜡的时间要根据季节,室温和试剂的新鲜谋面是在不同。如果在夏天,室温较高,脱蜡试剂也新鲜,则脱蜡 时间不需很多,3-5 分钟就已足够。如果在冬天,室温较低,脱蜡试剂也较陈旧,则脱蜡时间需要延长,10-20分钟或更长。
3、当天切的切片,烧烘烤2小时后进行染色,切片带有温度进行脱蜡这将可加速脱蜡的过程,如果预先切好烤好的切片,在染色前,还必须对切片进行加温10-20分钟,然后再行脱蜡,这样脱蜡速度加快,效果更好。
14) 如何最大限度地降低组织非特异性染色?
1、缩短一抗/二抗孵育时间、稀释抗体来控制。这是最重要的一条。
2、一抗用多克隆抗体易出现非特异性着色,建议试用单克隆抗体看看。
3、内源性过氧化物酶和生物素在肝脏、肾脏等组织含量很高(含血细胞多的组织),需要通过延长灭活时间和增加灭活剂浓度来降低背景染色;
4、非特异性组分与抗体结合,这需要通过延长二抗来源的动物免疫血清封闭时间和适当增加浓度来加强封闭效果;
5、缩短DAB孵育时间或降低 DAB浓度/过氧化氢浓度等;
6、适当增加PBS冲洗次数和浸洗时间,在一抗、二抗或SP孵育之后的浸洗尤为重要;
7、防止标本染色过程中出现干片,这容易增强非特异性着色。
15) 背景染色较深的原因有哪些?
1、抗体浓度过高:一抗浓度过高是常见的原因之一。解决办法是,每次使用新抗体前应当对其工作浓度进行测试,使每一抗体个体化,找到适合的理想工作浓度。
2、抗体孵育时间过长或温度较高:解决办法是,严格执行操作规程, 避免因遗忘而造成时间延长。现在流行的二步法(Polymer)敏感性很高,要求一抗孵育的时间不是传统的1小时,而是,30分钟,因此,要根据染色结果进行调整。
3、DAB 变质和显色时间太长:DAB最好现用现配,如有沉渣应进行过滤后再用。配制好的DAB不应存放时间太长,因为在没有酶的情况下,过氧化氢也会游离出氧原子与DAB产生反应而降低DAB的效力,未用完的DAB存放在冰箱里几天后再用这种似乎节约的办法是不可取的。DAB的显色最好在显微镜下监控,达到理想的染色程度时立即终止反应。不过当染色片太多时或用染色机时,这样做似乎不现实,但至少应对一些新的或少用的抗体显色时进行监控,避免显色时间过长。
4、组织变干:修复液溢出后未及时补充液体、染色切片太多、动作太慢、忘记滴液、滴液流失等都是造成组织变干的原因。
5、一抗变质、质量差的多克隆抗体:注意抗体的有效期,过期的抗体要么不显色要么背景着色。用新买抗体时最好设立阳性对照和用使用过的抗体作比较。
送检要求
样品类型 | 样本需求 | 保存条件 | 运输条件 |
动物组织 | 单个样品大于0.1g | -80℃ | 干冰 |
种子样本 | 单个样品大于0.2g | -80℃ | 干冰 |
细胞样本 | qPCR/WB:单个样本不少于106个细胞 | -80℃ | 干冰 |
血液样本 | 骨髓1-3ml;用抗凝管保存的外周血5-10ml | -80℃ | 干冰 |
石蜡包埋样本 | 包埋石蜡块大于0.1cm | -20℃ | 冰袋 |
抗体 | 提供足量,并附带抗体说明书 | -20℃ | 冰袋 |
引物 | 如需预实验,引物两对,附带引物合成单 | -20℃ | 冰袋 |
备注:每个样本仅保留唯一且清析可识的标记;邮寄前请与公司专业人员确认方法最佳; | |||

